FlourCam便携式光合联用叶绿素荧光成像系统
产品简介
详细信息
FlourCam便携式光合联用叶绿素荧光成像系统
 植物的光合速率、蒸腾速率、气孔导度等光合作用参数可以全面衡量植物光合作用的强度和能力;而叶绿素荧光不仅能反映光能吸收、激发能传递和光化学反应等光合作用的原初反应过程,而且与电子传递、质子梯度的建立及ATP合成和CO2固定等过程有关。对两者的结合测量在植物光合生理研究中缺一不可,对于衡量植物生长状况、不同胁迫处理对植物光系统的影响、评价生态系统碳收支与气候变化的相互关系、植物光系统对变化响应有着不可替代的作用。
植物的光合速率、蒸腾速率、气孔导度等光合作用参数可以全面衡量植物光合作用的强度和能力;而叶绿素荧光不仅能反映光能吸收、激发能传递和光化学反应等光合作用的原初反应过程,而且与电子传递、质子梯度的建立及ATP合成和CO2固定等过程有关。对两者的结合测量在植物光合生理研究中缺一不可,对于衡量植物生长状况、不同胁迫处理对植物光系统的影响、评价生态系统碳收支与气候变化的相互关系、植物光系统对变化响应有着不可替代的作用。
FlourCam便携式光合联用叶绿素荧光成像系统由FluorCam便携式植物荧光成像仪、LCpro-SD光合测量仪(或LCi-SD光合测量仪)和PAM调制式叶绿素荧光测量仪组成,组成了zui为全面、功能强大的植物光合生理研究工具。
系统组成

l FluorCam便携式植物荧光成像仪
 FluorCam便携式植物荧光成像仪被设计用来在田间和实验室内对叶片和小植物的荧光参数成像进行动力学解析,典型的研究区域为2.5x 2.5 cm。在所有应用中,系统可以对光化光和饱和光诱导的荧光瞬变过程进行成像,光化光照射的时间和强度可以由用户自定义的程序来决定。软件包中包含了zui常用的实验程序和简单实用且功能强大的程序设计语言,熟练的研究人员可以设计自己的闪光序列和测量过程。这是一个轻巧的便携系统,尤其适用于野外实验。系统可以通过肩背便携包中的密封锂电池在野外进行供电,稳固轻巧的三脚架使得野外测量变得简单易行。
FluorCam便携式植物荧光成像仪被设计用来在田间和实验室内对叶片和小植物的荧光参数成像进行动力学解析,典型的研究区域为2.5x 2.5 cm。在所有应用中,系统可以对光化光和饱和光诱导的荧光瞬变过程进行成像,光化光照射的时间和强度可以由用户自定义的程序来决定。软件包中包含了zui常用的实验程序和简单实用且功能强大的程序设计语言,熟练的研究人员可以设计自己的闪光序列和测量过程。这是一个轻巧的便携系统,尤其适用于野外实验。系统可以通过肩背便携包中的密封锂电池在野外进行供电,稳固轻巧的三脚架使得野外测量变得简单易行。
FluorCam便携式植物荧光成像仪既可以单独使用,也可以通过适配叶夹与LCpro-SD光合测量仪组成联用系统,同步测量植物光合和叶绿素荧光。
l  LCpro-SD光合测量仪
LCpro-SD光合测量仪
LCPro-SD便携式光合仪为智能型便携式光合作用测定仪,用以测量植物叶片的光合速率、蒸腾速率、气孔导度等与植物光合作用相关的参数。仪器应用IRGA(红外气体分析)CO2分析模块和双激光调谐快速响应水蒸气传感器精密测量叶片表面CO2浓度及水分的变化情况来考察叶片与植物光合作用相关的参数。通过人工光源、CO2控制单元和温度控制单元可以同时精确调控环境条件,从而测定光强、CO2浓度和温度对植物光合系统的影响。本仪器可在高湿度、高尘埃等恶劣环境中使用,具有广泛的适用性。
l PAM调制式叶绿素荧光测量仪
 选配一、OS5p调制叶绿素荧光测量仪
选配一、OS5p调制叶绿素荧光测量仪
OS5p调制叶绿素荧光测量仪通过测量叶绿素荧光可以反映几乎所有类型的植物逆境胁迫,测量模式多于目前的其他任何一款便携式荧光仪,采用创新性技术,提高测量结果可靠性,野外便携,持久耐用。通过光合-荧光联用适配器可以与LCpro-SD光合测量仪组成联用系统,可以实时同步测量植物的光合和叶绿素荧光。
选配二、FP100手持式叶绿素荧光测量仪
FP100手持式叶绿素荧光测量仪是现在世界上zui为轻便小巧的叶绿素荧光测量仪,但在功能上不逊于其他便携式叶绿素荧光测量仪。它采用调试式荧光测量技术,可设置多种参数,方便测量多种植物叶绿素荧光。外观小巧,方便携带,使用灵活,操作简单,经济耐用,精度高稳定性好。自带暗适应叶夹,操作简便。
应用领域
l  植物光合生理研究
植物光合生理研究
l 植物抗胁迫研究
l 碳源碳汇研究
l 植物对气候变化的相应及其机理
l 作物新品种筛选
l 生物和非生物胁迫的检测
l 植物抗胁迫能力或者易感性研究
l 气孔非均一性研究
l 代谢混乱研究
l 长势与产量评估
l 植物——微生物交互作用研究
l 植物——原生动物交互作用研究
技术特点
l 全部为便携式设计,体积轻小,可用于野外测量,也可用于室内实验
l 可在恶劣环境下使用,均配有可更换电池,采用低能耗技术,可以支持长时间野外实验
l 材料经精心选择,以确保测量精度
l 数据存储量大,读取简便
l 维护方便,所有区域都很容易清洁
l 具备实时数据显示功能
技术指标
FluorCam便携式植物荧光成像仪
· 可以被安装在LCpro-SD等气体交换系统光合仪的标准叶室上
· 高灵敏度CCD镜头,时间分辨率可达每秒50帧,512 x 512 像素
· 可测荧光参数:F0, Fm, FV, FO', Fm', FV', QY(II)), NPQ, FV/Fm, FV'/Fm', Rfd, qN, qP等50多个
· 4块超亮LED光源板,均一照明面积2.5 X 2.5 cm。
· 测量光为620nm红光,其它波段(白光, 蓝光455 nm)可选,持续时间10µs - 100µs可调;
·  光化学光、饱和光闪,标配红光(620nm)或蓝光(455nm)
光化学光、饱和光闪,标配红光(620nm)或蓝光(455nm)
· 远红光:IR735nm
· 给光制度:静态或者动态模式
· 自定义实验程序:多样化的时间顺序,专门的程序语言和脚本
· FluorCam软件包括下列实验测量程序(protocols):Fv/Fm、Kautsky诱导效应、荧光淬灭分析、光响应曲线等,可任意调整测量时间、光化学光持续时间、测量间隔、光强等参数
· FluorCam软件具图像处理、选区ROI、测量分析等功能,可输出成像视频、图表、直方图等
· CCD检测器带宽:400–1000 nm
· 像素尺寸:8.2 µm x 8.4 µm
· 成像频率:50 张图片每秒
· 通讯方式:USB 2.0
· 重量:1.8 kg
LCpro-SD光合测量仪
l CO2测量范围:0-3000ppm
l  CO2测量分辨率:1ppm
CO2测量分辨率:1ppm
l CO2采用红外分析,差分开路测量系统,自动置零,自动气压和温度补偿
l H2O测量范围:0-75 mbar
l H2O测量分辨率:0.1mbar
l PAR测量范围:0-3000 μmol m-2 s-1,余弦校正
l 叶室温度:-5 - 50℃ 精度:±0.2℃
l 叶片温度:-5 - 50℃ 精度:±1.5℃
l 空气泵流量:100 - 500ml / min
l CO2控制:由内部CO2供应系统提供zui高2000ppm
l H2O控制:可高于或低于环境条件
l 温度控制:由微型peltier元件控制,可高于或低于环境14℃
l PAR控制:由高效、低热红/蓝LED阵列单元控制,zui高2000μmol m-2 s-1可选配多种带有光源的可控温叶室、叶夹
|
|
|
|
宽叶叶室 | 窄叶叶室 | 针叶叶室 | 土壤呼吸室
|
|
|
|
|
小型叶叶室 | 小型草本植物群落测量室 | 整株拟南芥测量室 | 果实测量室 |
l 数据存储:1G SD卡,可存储16,000,000组典型数据
l 供电系统:内置12V 7AH蓄电池,可持续工作至16小时,智能充电器
l 尺寸:主机230×110×170mm,测量手柄300×80×75mm
l 重量:主机4.4Kg,测量手柄0.8Kg
OS5p调制叶绿素荧光测量仪
· 光源
饱和脉冲:卤光灯与LED。卤光灯zui大光强0-15,000 μmolm-2s-1;LED 0-4,500 μmolm-2s-1
调制光:红光660nm LED,和蓝光450nm LED
 光化光:可调。LED光源:0-3,000 μmolm-2s-1
光化光:可调。LED光源:0-3,000 μmolm-2s-1
卤光灯:0-6,000μmolm-2s-1
远红光:735nmLED(用来测定Fod或Fo’),强度可调。
· 检测模式:脉冲调制模式
· 探测器&过滤器:光敏二极管插孔,700nm -750nm带通滤波器
· 调制频率:25Hz –1MHz自动调整。
· 采样周期:2s – 45min或者2s-16h范围内可调
· 数据存储:1Gb的内存容量,能存储上万组数据。
· 数据输出:MMC/SD卡,以太网络,USB&RS232标准输出
· 主机显示屏:320×240 LCD,带背景灯,触摸屏
· 供电:71瓦时可充锂电池,电池电量:支持达20小时连续测量
· 尺寸:13cm×18cm×14cm
· 重量:1.4kg
FP100手持式叶绿素荧光测量仪
· 测量参数:Fo,Ft,Fm,Fm´,QY,OJIP, NPQ 1,2 和光曲线1,2,3。
· 测量光:蓝光(可选红光或白光)
·  光化学光和饱和光:0–3000µmol (photons).m-2.s-1可调
光化学光和饱和光:0–3000µmol (photons).m-2.s-1可调
· 波长检测范围:697nm-750nm
· BOIS:可升级
· 通讯:USB接口
· 存储:4M
· 数据存储:100,000个
· 显示:2 x 8字符黑白液晶屏
· 键盘:密封防水设计2键
· 自动关机:5分钟无操作
· 电源:4 AAA碱性电池或充电电池
· 电池寿命:持续测量70 h
· 尺寸:120 x 57 x 30 mm; 4.7" x 2.2" x 1.2"
· 重量:180 g, 6.5 oz
· 软件:FluorPen2.0, Windows 2000,XP或更高,实时显示和遥控,植入GPS绘图,EXCEL输出
· PAR传感器:读数单位µmol(photons)/m².s,可显示读数,检测范围400-700 nm
应用案例
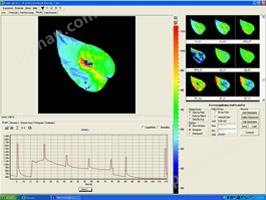
 1. 光合荧光成像联用
1. 光合荧光成像联用
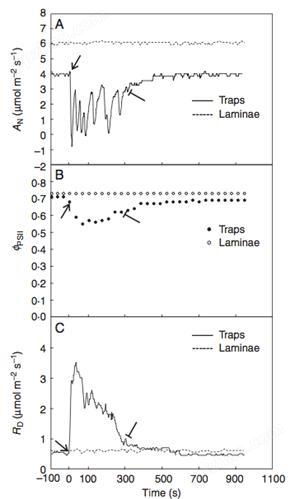
Andrej Pavlovic博士利用便携式光合联用型叶绿素荧光成像系统FC1000-LC,对捕蝇草等捕食性植物进行了叶绿素荧光特性及光合作用研究,其博士在读期间发表的研究论文“Trap closure and prey retention in Venus flytrap (Dionaea muscipula) temporarily reduces photosynthesis and stimulates respiration”因此获Annals of Botany 研究生奖(Graduate Prize)。
右图为Pavlovic博士利用FC1000-LC和光合仪联用的研究结果,对捕蝇草的“陷阱”进行刺激(图中箭头所示)后,其光合作用(上图)、有效光量子产量(叶绿素荧光参数,见中图所示)均立即降低,其呼吸作用(下图)随之增强。
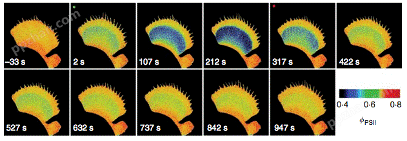
2. 光合荧光联用
1) 基本应用
对多花蔷薇(Rosa multiflora)的净光合速率、量子产额和电子传递速率进行同步测量。
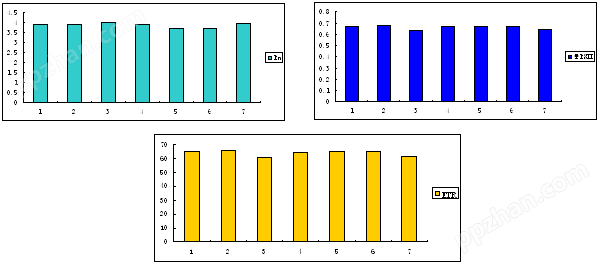
 这种同步测量提高了获取数据的准确性,尽量减小了环境因素和植物本身生理状态对数据的影响,但没有将光合和叶绿素荧光的数据有机结合起来。
这种同步测量提高了获取数据的准确性,尽量减小了环境因素和植物本身生理状态对数据的影响,但没有将光合和叶绿素荧光的数据有机结合起来。
2) 高级应用
同步测定重度干旱胁迫下如意蔓(Plectranthus verticillatus)光合速率和叶绿素荧光的相关性。使用光合仪配备的人工光源模拟不同光强,同时测定净光合速率、量子产额和电子传递速率。
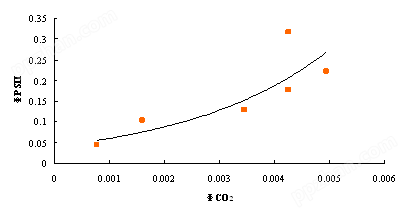
① ΦPSII和ΦCO2的相互关系
CO2量子产量和PSII量子产量并没有呈线性关系。ΦPSII的升高速度要高于ΦCO2,表明如意蔓在干旱胁迫下有较强的光呼吸。
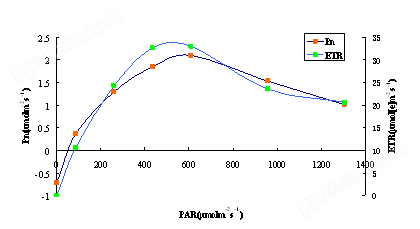
② Pn和ETR的光响应曲线
同步测定如意蔓光合速率和ETR的光响应曲线。发现两者的变化趋势基本相同。在光强大约为500μmol m-2s-1时达到zui大。在更高的光强下,因为光抑制而逐渐下降。
产地:欧洲、美国
参考文献(仅2009年后部分文献)
1. Photosynthetic characterization of Australian pitcher plant Cephalotus follicularis. A Pavlovi, 2011. Photosynthetica
2. Activation of violaxanthin cycle in darkness is a common response to different abiotic stresses: a case study in Pelvetia canaliculata. B Fernandez-Marin, et al, 2011. BMC Plant Biology
3. Engineered drought tolerance in tomato plants is reflected in chlorophyll fluorescence emission. KB Mishra, et al, 2011. Plant Science
4. A Novel Component of the Disulfide-Reducing Pathway Required for Cytochrome c Assembly in Plastids. ST Gabilly, et al, 2011. Genetics
5. Chlorophyll fluorescence emission as a reporter on cold tolerance in Arabidopsis thaliana accessions. A Mishra, et al, 2011. Plant Signaling & behavior
6. Evidence for a role of raffinose in stabilizing photosystem II during freeze–thaw cycles. M Knaupp, et al, 2011. Planta
7. On the mechanism underlying photosynthetic limitation upon trigger hair irritation in the carnivorous plant Venus flytrap (Dionaea muscipula Ellis). A Pavlovi?, et al, 2011. Journal of experimental botany
8. Variation in seedling freezing response is associated with climate in Larrea. JS Medeiros, et al, 2011. Oecologia
9. Nutritional benefit from leaf litter utilization in the pitcher plant Nepenthes ampullaria. A Pavlovi?, et al, 2011. Plant, Cell & Environment
10. At mutant Arabidopsis plants induce compensation mechanisms to reduce the negative effects of the mutation. I Majláth, et al, 2011. Journal of plant physiology
11. Root nutrient uptake enhances photosynthetic assimilation in prey-deprived carnivorous pitcher plant Nepenthes talangensis. A Pavlovi?, et al, 2010. Photosynthetica
12. Gabaculine alters plastid development and differentially affects abundance of plastid-encoded DPOR and nuclear-encoded GluTR and FLU-like proteins in spruce cotyledons. V Demko, et al, 2010. Journal of Plant Physiology
13. Spatio-temporal changes of photosynthesis in carnivorous plants in response to prey capture, retention and digestion. A Pavlovi?, 2010. Plant Signaling & Behavior
14. Trap closure and prey retention in Venus flytrap (Dionaea muscipula) temporarily reduces photosynthesis and stimulates respiration. A Pavlovi?, et al, 2010. Annals of botany
15. 冰核细菌对低温胁迫下枇杷光合参数和叶绿素荧光参数的影响。郑国华等, 2010。中国生态农业学报
16. Fluoranthene influences endogenous abscisic acid level and primary photosynthetic processes in pea (Pisum sativum L.) plants in vitro. L Váňová, et al, 2009. Plant Growth Regulation
17. Feeding enhances photosynthetic efficiency in the carnivorous pitcher plant Nepenthes talangensis. A Pavlovi?, et al, 2009. Annals of botany
18. Chlorophyll biosynthesis and chloroplast development in etiolated seedlings of Ginkgo biloba L.. A Pavlovi?, et al, 2009. Photosynthetica
19. Water use ef?ciency and photosynthesis of glyphosate-resistant soybean as affected by glyphosate, Zobiole LHS et.al. 2010, Pesticide Biochemistry and Physiology
20. Nutrient accumulation and photosynthesis in glyphosate-resistant soybeans is reduced under glyphosate use, Zobiole LHS et.al. 2010, Journal of Plant Nutrition
21. Membrane transporters and carbon metabolism implicated in chloride homeostasis differentiate salt stress responses in tolerant and sensitive Citrus rootstocks, Brumós J et.al. 2009, Funct Integr Genomics
22. Maintenance of a high photosynthetic performance is linked to flooding tolerance in citrus, Arbona V et.al. 2009, Environmental and Experimental Botany
23. Relationship between salt tolerance and photosynthetic machinery performance in citrus, López-Climent MF et.al. 2008, Environmental and Experimental Botany
24. The Effects of Elevated CO2 on Tropical Trees Are Related to Successional Status and Soil Nutritional Conditions, Martinez CA et.al. 2008, Photosynthesis. Energy from the Sun
25. Antioxidant response and photosynthetic characteristics of Xerophyta viscosa Baker and Digitaria sanguinalis L. leaves induced by high light, Ekmekci Y et.al. 2004, Israel Journal of Plant Sciences
26. Effect of Photorespiratory C2 Acids on CO2 Assimilation, PS II Photochemistry and the Xanthophyll Cycle in Maize, González-Moro MB, et.al. 2003, Photosynthesis Research
27. Growth and production of buckwheat (Fagopyrum esculentum) treated with reduced, ambient, and enhanced UV-B radiation, Gaberš?ik A et.al. 2002, Journal of Photochemistry and Photobiology B: Biology









